上海2021年5月19日 /美通社/ -- Veeva Systems(纽交所代码:VEEV) 发布消息:在刚刚举办的第四届中国IRT论坛上,Veeva R&D CSM高级经理张金金围绕“全球化背景下临床运营系统的变革”的主题进行了分享,从临床运营系统产品设计、产品管理到产品服务的革新,她对临床研究运营领域信息化管理的深刻见解,给在场嘉宾带来了深刻启发和思考。
1. 全球化形势下临床运营系统面临的挑战
随着NMPA加入ICH并于2018年成功加入管委会成员,国际多中心临床试验数量大大增长。同时,临床试验机构资质认定实行备案管理,直接对临床实验项目进行全过程的监管,临床试验默示许可制度、伦理前置、临床试验暂停机制等,都给临床运营团队带来了巨大的压力。
全球的药品监管部门,都明确了药企对CRO以及其他第三方合作方提出了监管的职责并且强调TMF质量的重要性。所以我们临床领域面临法规更高的要求、对质量的追求、对监管的重视 -- 临床试验运营系统也面临着同样的巨大挑战。
挑战1:传统的临床运营系统跟不上时代的步伐
挑战2:缺少运营系统管理策略 无法量化系统收益
挑战3:需要高效的合作沟通以及质量监管可视化工具
为了更好地服务临床运营团队,传统的临床运营系统需要从产品设计、产品的运行管理和应对法规监管方面,都需要相应变革。
2. 临床运营系统产品设计的变革
首先来看临床运营产品从设计层面的变革。众所周知行业内最大的痛点和难点是EDC和CTMS系统集成,所以搭建以受试者为中心的集数据和运营管理为一体的数字化平台至关重要。临床运营系统的一体化有利于项目管理和文档管理的有机结合。
Veeva推出的Vault eTMF的主动管理模式,支持实时的审计检查,更具可视性和可控性。Veeva Vault CTMS和eTMF的集成也有助于主数据的分享和维护,以及贯穿全流程的实时的监督,及时调整计划和方案,规避合规性风险。
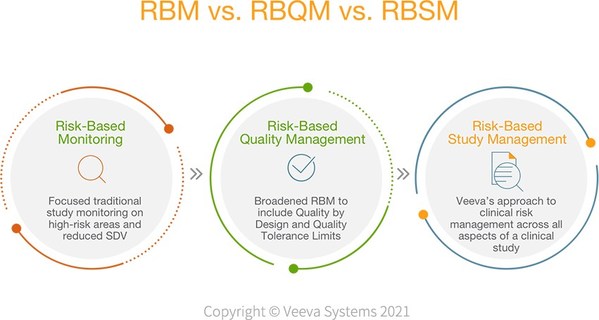
Veeva推出了RBSM (Risk-Based Study Management) 的概念,基于风险的临床试验项目的管理,采纳了关于RACT的标准,关于风险评估和分类工具,通过系统的工具运用到具体的临床试验项目中,以量化的方式了解临床试验项目的风险情况,并且自动化的匹配和推送风险规避的措施,为基于风险的管理提供切实可行的途径。
Veeva推出了RBSM (Risk-Based Study Management) 的概念,基于风险的临床试验项目的管理,采纳了关于RACT的标准,关于风险评估和分类工具,通过系统的工具运用到具体的临床试验项目中,以量化的方式了解临床试验项目的风险情况,并且自动化的匹配和推送风险规避的措施,为基于风险的管理提供切实可行的途径。
3. 临床运营系统评估管理的变革
Veeva组成了由医药行业内的专家团队,包括来自Sponsor或CRO等具有丰富临床研究领域经验的专家小组,开发了应用于临床运营系统管理的成熟度模型评估体系。
通过模型的搭建,我们在行业领域持续应用十几年,深刻地做了管理方面的变革,我们根据Veeva Vault eTMF在项目和临床运营过程中流程方面的重要地位和作用划分了5个等级。
从TMF的策略,组织结构,流程的一致性,内外部合作,合规性管控等全方位地了解用户对于TMF的使用现状,并通过成熟度模型中对应的等级来评估和量化,从而了解现状以及和期望的差距,并与行业标准进行对比。最终结合实际需求来形成个性化的改进方案。
针对评估结果通过雷达图就能一目了然地了解到我们TMF使用现状,以及跟行业平均值、目标期望值进行对比。由Veeva专家团队协助挑选3~4个关键指标,制定长达一年到一年半的计划,包括通过系统的配置来优化系统流程,对用户进行相关培训,来增加客户和用户对系统的使用的熟悉程度,最终通过一年的努力,希望能够达到预期标准,并通过再度的重新评估,来对比它是否能达到当时的预期,以及还有哪些方面可以改进。
4. 临床运营系统应对合作和监管的变革
在合规和监管方面,Veeva也做出了相应变革。Veeva Vault eTMF基于行业内最佳实践,在跟CRO的合作过程中,从文档层面比如上传数量、文档完成情况、工作流的及时性、超期情况等进行统计,按照月度或者年度统计数据来对比Sponsor和CRO在系统中对文档的贡献。Veeva临床运营系统包括启动环节SSU,文档管理eTMF和项目管理CTMS,在整个临床试验启动、执行和结束阶段,都有推荐的监控的量化的关键指标。
此外,TMF的重要输出在各方的转移也是非常重要的问题,存在TMF文件迁移的多元化需求。包括CRO和Sponsor之间,试验结束阶段,文档全部完成QC并且归档前需要进行文档的迁移。如果Sponsor之间存在合作,比如文档上市或者退市阶段,也是需要文档转移的。
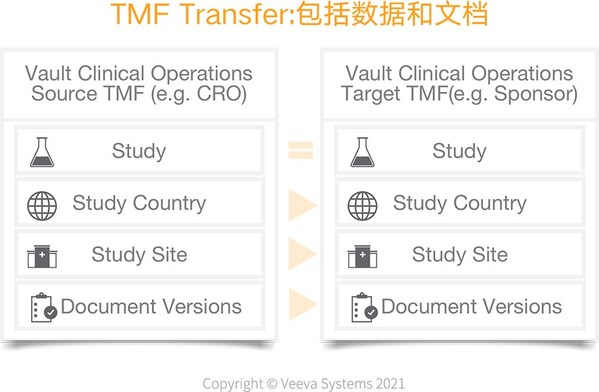
TMF的重要输出在各方的转移。包括CRO和Sponsor之间,试验结束阶段,文档全部完成QC并且归档前需要进行文档的迁移。如果Sponsor之间存在合作,比如文档上市或者退市阶段,也是需要文档转移的。
Veeva临床运营系列产品自问世以来,每年保持3个版本的发布,坚持不懈地在优化产品、相应法规要求,采纳行业内最佳实践方面持续的改进,并且售后的专家团队持续致力于客户成功,真正做到了从产品设计本身、产品管理以及产品服务方面的革新。将来也希望我们从更全面的角度考虑,来提升产品的质量,产品的服务,在临床研究运营过程中发挥更重要的作用。
更多信息
更多关于Veeva的信息,请访问:https://www.veeva.com/cn/
关注维我软件微信请搜索微信号:VeevaCN
关于Veeva Systems
Veeva Systems是全球领先的生命科学行业基于云计算模式的商业解决方案提供商。致力于提供创新的技术架构,卓越的产品服务,以及遵循让客户成功的服务理念。
目前,Veeva在全球范围内服务超过950家企业客户,这些客户中有全球最大的制药公司,也有新兴的生物技术公司。Veeva总部设在美国旧金山湾区,并在欧洲、亚洲和拉丁美洲设有办事处。更多信息,请访问:www.veeva.com 。
前瞻性声明
本新闻稿中载列了前瞻性声明,内容涵盖市场对Veeva产品和服务的需求和认可、使用Veeva的产品和服务所取得的效果,以及一般商业情况,尤其是生命科学行业的商业现状。本新闻稿中载列的任何前瞻性声明都基于Veeva的历史业绩和当前计划、估算业绩和预期而做出,并不代表这些计划、估算业绩和预期一定会实现。本前瞻性声明是Veeva发布本新闻稿之时的预期,可能需要根据后续事态发展做出变更,但Veeva无义务在今后更新本声明。在做出本前瞻性声明之时,存在多种已知和未知的风险及不确定性,有可能造成实际结果与预期相去甚远。在截至2019年10月31日对10-Q表的备案文件中,“风险因素”和“管理层对财务状况和运营结果的讨论与分析”部分列出了可能影响Veeva财务结果的其他风险和不确定性。该文件载于公司官网:veeva.com“投资者”一栏及美国证券交易委员会网站sec.gov。欲了解更多有关可能影响实际业绩的潜在风险,请参阅Veeva向美国证券交易委员会提交的其他备案文件。

