苏州2021年3月24日 /美通社/ -- 康宁杰瑞生物制药(股票代码:9966.HK,以下简称“康宁杰瑞”或公司)公布公司2020年全年公司业务进展及财务业绩。
康宁杰瑞董事长兼总裁徐霆博士表示:“2020年是康宁杰瑞发展史上具有里程碑意义的一年,公司多项业务均取得了关键进展。全球首个皮下注射PD-L1抑制剂恩沃利单抗递交上市申请,于春节前获得优先审评资格;4项关键临床研究启动,3个在研产品获得美国FDA授予孤儿药资格,9项IND获批;双特异性抗体KN046、KN026在全球多项临床研究中获得积极的数据;公司与辉瑞、赛诺菲、中科院上海巴斯德研究所等10个国内外合作伙伴达成战略合作;设计总产能超过3万升的新生产基地一期生产线获得了药品生产许可证。
2021年,公司预期将迎来第一个获批上市的产品,这意味着我们将从研发创新的biotech正式步入商业化阶段。目前公司自主研发的高度差异化管线产品已从9个扩展至16个。包括前默克中国研发中心负责人Johannes Nippgen博士在内的多名高管陆续加入公司,公司管理团队进一步壮大。今年我们预期将看到KN046首个Ⅲ期临床研究的中期分析数据,多项临床研究数据将在今年召开的国际学术会议上公布,多项新的关键/注册临床研究将在今年启动……公司全员已经做好充分的准备,迎接新的机遇和挑战,持续用我们的创新成果为患者、股东和社会创造新的价值,为践行公司使命、助力健康美好的未来而前行。”
公司业务发展亮点
一、产品管线
公司高度差异化的内部管线由十六种候选药物组成,其中一种已提交BLA、三种处于临床后期阶段,并计划于2021年提交2至3项IND申请。
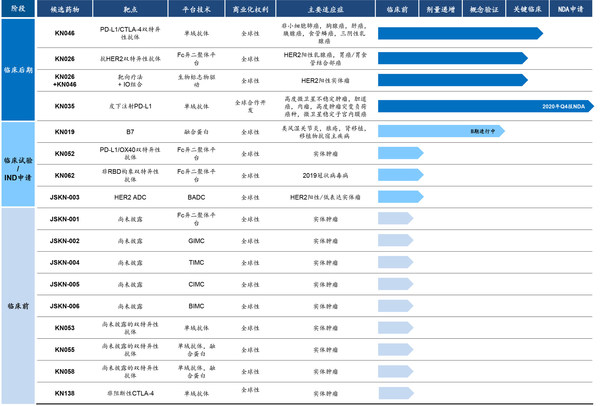
产品管线概览
KN035(恩沃利单抗注射液)
全球第一个可皮下注射的PD-L1抑制剂,具有安全性、便利性、依从性、适用于不适合静脉输液的患者以及较低的医疗成本等优点。KN035的首个BLA获中国国家药品监督管理局受理并获得优先审评,预计在今年获批上市。
报告期间内进展
- 公司在2020年ASCO年会上公布KN035针对错配修复功能缺陷晚期肿瘤患者及KN035和化疗联合疗法用于治疗晚期胃或胃食管结合部肿瘤(GC/GEJ)的临床试验结果。
- 2020年7月16日,公司帮助美国合作伙伴TRACON提交关于KN035用于两种软组织肉瘤亚型(ENVASARC)(分别为未分化多形性肉瘤及粘液纤维肉瘤)关键试验的IND申请。8月14日,TRACON收到FDA关于该研究可在美国进行的批准通知。
- 2020年12月,在美国的ENVASARC注册临床试验完成首例患者给药。
- 2020年12月17日,KN035的BLA获中国国家药监局受理,申请的适应症为标准治疗失败的微卫星不稳定(MSI-H)/错配修复功能缺陷(dMMR)晚期结直肠癌、胃癌及其他晚期实体瘤。
报告期间后进展
- 2021年1月,KN035获中国国家药监局药品审评中心授予优先评审。
KN046
一种双特异性抗体,同时靶向两个临床验证的免疫检查点PD-L1及CTLA-4,为具有潜在突破性的新一代肿瘤免疫重磅药物。目前,中国、美国及澳大利亚有约20项涵盖10多类肿瘤、处于多个阶段的临床试验正在进行中,包括非小细胞肺癌(NSCLC)、肝癌(HCC)、胰腺癌、三阴乳腺癌(TNBC)、食管癌(ESCC)及胸腺癌等。临床试验的结果显示了KN046良好的安全性及初步有效性。
报告期间内进展
- 2020年4月15日,江苏康宁杰瑞收到FDA的批准通知,批准KN046可在美国针对NSCLC进行Ⅱ期临床试验。
- 2020年5月12日,江苏康宁杰瑞两项IND申请获得CDE批准,包括:评估KN046联合KN026治疗HER2阳性或HER2表达实体肿瘤的有效性、安全性及耐受性的Ⅰb期临床研究;对甲苯磺酸宁格替尼联合KN046治疗晚期HCC的多中心、开放式标签Ⅰb/Ⅱ期临床试验。
- 公司在2020年ASCO年会上公布KN046在中国针对之前ICI(免疫检查点抑制剂治疗)失效的患者的剂量递增及扩展Ⅰa/Ⅰb期临床试验的初步疗效和安全性数据。结果显示耐受性良好,KN046对以往ICI治疗失败的晚期实体肿瘤患者表现出良好的安全性及前景良好的临床益处。
- 2020年9月2日,FDA授予KN046孤儿药资格,用以治疗胸腺上皮肿瘤(TET)。
- 2020年9月3日,江苏康宁杰瑞正式在中国和美国启动KN046治疗胸腺癌的关键性Ⅱ期临床试验。
- 2020年9月,江苏康宁杰瑞完成ENREACH-LUNG-01首例患者给药。ENREACH-LUNG-01是一项评估KN046联合铂基化疗在晚期不可切除或转移性鳞状NSCLC患者中的疗效与安全性的多中心、随机、双盲、安慰剂对照Ⅲ期临床试验。
报告期间后进展
- 2021年1月,ENREACH-Thymic注册临床试验完成首例患者给药。ENREACH-Thymic是一项评估KN046用于晚期胸腺癌的疗效、安全性和耐受性的关键性Ⅱ期、开放式标签、多中心临床研究。
- 2021年1月,公司在2021 ASCO胃肠道肿瘤研讨会年会上展示KN046联合放化疗治疗复发和转移性ESCC的初步疗效及安全性的数据。
- 2021年2月,KN046联合泽璟研发的口服多重激酶抑制剂多纳非尼片治疗晚期或转移性HCCⅠ/Ⅱ期临床试验完成首例患者给药。
- 公司在WCLC 2020上展示KN046治疗晚期NSCLC患者的Ⅱ期临床研究数据。中位随访期为13个月,中位PFS为3.68个月(95% CI:3.35,7.29),其中鳞状NSCLC和非鳞状NSCLC分别为7.29个月(3.68,9.23)和3.58个月(2.46,5.52),优于中国患者采用PD-1疗法的历史数据。其表明KN046具有良好的耐受性,用于晚期NSCLC的二线治疗有效,在NSCLC中显示出PFS及OS获益。
- 公司在WCLC 2020上展示KN046治疗罕见胸部肿瘤患者的Ⅰ期临床研究的初步安全性及疗效数据。在胸腺上皮肿瘤中的已确认ORR为50%,未确认ORR为75%,DCR为100%。
KN026
新一代抗HER2双特异性抗体,可以同时结合两种不同的经临床验证的HER2表位,从而产生潜在的卓越疗效。
报告期间内进展
- 2020年5月12日,江苏康宁杰瑞两项IND申请获得CDE批准,包括:评估KN026联合KN046治疗HER2阳性或HER2表达实体肿瘤的有效性、安全性及耐受性的Ⅰb期临床研究;评估KN026作为单一疗法或联合治疗HER2低表达或HER2阳性复发/转移性乳腺癌(mBC)有效性及安全性的Ⅱ期临床研究。
- 公司在2020年ASCO年会上公布KN026在中国针对HER2阳性转移性乳腺癌(mBC)患者的Ⅰ期临床试验数据。结果显示,KN026耐受性良好,在标准抗HER2治疗失败的HER2阳性乳腺癌患者中显示出令人鼓舞的抗肿瘤活性。
- 公司在SITC 2020上展示初步临床数据。KN026与KN046的联合疗法已于针对标准治疗失败的HER2阳性实体瘤患者的Ⅰb期临床试验取得初步正面结果。
- 2020年12月,江苏康宁杰瑞KN026联合KN046的Ⅱ期临床试验SEARCH-01研究完成首例患者给药。SEARCH-01是一项开放式标签、Ⅱ期、多中心临床研究,旨在评估KN026联合KN046治疗HER2阳性实体瘤的有效性、安全性和耐受性。
- 2020年12月,FDA授予KN026及KN046联合疗法孤儿药资格,用于治疗HER2阳性或低表达胃癌及胃食管连接部癌(GC/GEJ)。这是FDA授予公司的第三个孤儿药资格。
- 2020年12月,公司收到中国国家药监局就KN026联合爱博新®(哌柏西利)或KN026与爱博新®(哌柏西利)和氟维司群联合疗法的IND申报批准,用于曲妥珠单抗和紫杉类药物治疗失败的HER2阳性局部晚期不可切除及/或转移性乳腺癌的治疗。
二、业务运营
报告期间内动态
- 2020年5月22日,江苏康宁杰瑞与InxMed订立一份合作伙伴协议,共同开展KN046与黏著斑激酶抑制剂IN10018作为联合疗法,以探索KN046与IN10018联合用药的协同增效作用。
- 2020年5月28日,江苏康宁杰瑞与广东东阳光订立新合作协议以扩大原有合作,双方同意共同开发多靶点小分子激酶抑制剂CT053(对甲苯磺酸宁格替尼)与KN046用于实体肿瘤领域的抗肿瘤联合疗法。
- 2020年6月9日,江苏康宁杰瑞与赛诺菲订立独家选择权协议以进行战略合作,推进KN026与赛诺菲的产品泰索帝®联合用于HER2阳性乳腺癌患者的临床研究。
- 2020年6月10日,江苏康宁杰瑞与上海巴斯德研究所订立合作开发协议,就COVID-19多特异中和抗体的共同开发、生产及商业化进行合作。
- 2020年6月19日,江苏康宁杰瑞与信诺维订立一份合作伙伴协议,推动KN046与小分子抑制剂XNW7201作为联合疗法在肿瘤适应症的开发。
- 2020年7月30日,江苏康宁杰瑞与开拓药业订立一份合作伙伴协议,以共同开发KN046及GT90001治疗HCC的联合疗法。
- 2020年7月,公司获苏州自由贸易区认定为首批高新技术企业;获认定为江苏省国际研发中心。
- 徐博士获苏州市政府授予第六届“苏州杰出人才奖”。
- 康宁杰瑞生物制药(9966.HK)获纳入恒生综合指数。
- 2020年11月底,公司在2020年中国医药企业家科学家投资家大会上获授予“中国医药创新企业100强”。
- 公司获纳入深港通下的港股通股票名单,并自2020年12月28日起生效。
报告期间后动态
- 2021年1月6日,公司在深圳举办的第五届金港股年度颁奖盛典上获授予“最佳医药及医疗公司”奖。
- 康宁杰瑞管理团队进一步扩充,包括委任Johannes Nippgen博士为首席医学官。
三、生产基地
江苏康宁杰瑞新生产基地Ⅰ期2x2,000L生产线(设计总产能超过30,000L)已于2020年7月取得江苏省药品监督管理局颁发的药品生产许可证。生产线配备符合中国国家药监局、FDA及欧洲药品管理局有关GMP监管规定的世界一流的设备。
2020年全年财务摘要
- 截至2020年12月31日止年度,本集团录得其他收入人民币111.1百万元(相比截至2019年12月31日止年度录得人民币34.4百万元),主要包括利息收入、政府补助及其他杂项收入。
- 截至2020年12月31日止年度,录得其他亏损人民币117.6百万元(相比截至2019年12月31日止年度录得人民币0.3百万元)。截至2020年12月31日止年度,公司亏损及全面开支总额为人民币427.8百万元(相比截至2019年12月31日止年度为人民币832.7百万元)。
- 截至2020年12月31日止年度,研发开支为人民币331.2百万元(相比截至2019年12月31日止年度录得人民币166.7百万元)。主要由于正在进行的临床试验数目增加;临床研究规模的扩大;候选药物的临床试验进展;研发人员增加令员工成本增加及薪酬增加所致。
- 截至2020年12月31日止年度的行政开支为人民币78.2百万元(相比截至2019年12月31日止年度录得人民币117.7百万元)。
有关上述内容的更多信息,请参阅本公司在香港联交所及公司官网上发布的2020年度业绩公告。
关于康宁杰瑞
康宁杰瑞生物制药专注于研发、生产和商业化创新抗肿瘤药物。2019年12月12日,公司在香港联合交易所主板上市,股票代码:9966。
康宁杰瑞生物制药在双特异性抗体及蛋白质工程方面拥有全产业链的发现、研发和制造平台。公司产品管线包括具有自主知识产权的、高度差异化的15种以双抗为主的抗肿瘤候选药物,和一种Covid-19的多功能抗体,其中四个产品在中国、美国、日本、澳大利亚处于Ⅰ-Ⅲ期临床。恩沃利单抗注射液(KN035)上市申请已获国家药品监督管理局(NMPA)正式受理并纳入优先审评。
公司拥有异二聚体及混合抗体等多个具有自主知识产权的技术平台,和符合中国、美国和欧盟cGMP标准的大规模生产能力,并且通过包括欧盟QP在内多次审计的完整的质量体系。公司致力于建设国际领先的、多维度的药物开发和产业化平台,聚焦多功能生物大分子新药,惠及中国和全球的患者。
欢迎访问公司网站:www.alphamabonc.com

