歌礼宣布同类首创、每日一次、口服FASN抑制剂ASC40痤疮II期临床试验达到终点
中国杭州和绍兴2023年5月2日 /美通社/ -- 歌礼制药有限公司(香港联交所代码:1672,"歌礼")今日宣布,同类首创、每日一次、口服脂肪酸合成酶(FASN)抑制剂ASC40(Denifans...
歌礼(1672.HK)被纳入恒生香港上市生物科技指数
中国杭州和绍兴2023年2月27日 /美通社/ -- 歌礼制药有限公司(HKEX: 1672, "歌礼")宣布被纳入恒生香港上市生物科技指数(指数代码:HSHKBIO),将于2023年3月13日生效...
歌礼在2023 CROI大会公布广谱抗病毒双前药ASC10积极I期临床数据
--在800毫克ASC10、每天两次的剂量下,活性药物ASC10-A的暴露量与莫诺拉韦的相当 --800毫克ASC10、每天两次的安全性和耐受性良好 --确定了ASC10以800毫克、每天两次的剂量在...
亚太肝脏研究协会2023年年会口头报告显示皮下注射PD-L1抗体ASC22可以实现慢乙肝功能性治愈
中国杭州和绍兴2023年2月16日 /美通社/ -- 歌礼制药有限公司(香港联交所代码:1672,"歌礼")今日宣布在亚太肝脏研究协会2023年年会的口头报告显示皮下注射PD-L1抗体ASC22(恩...
歌礼宣布美国食药监局批准开展ASC10治疗呼吸道合胞病毒感染IIa期临床试验
--目前全球尚无治疗呼吸道合胞病毒(RSV)感染的有效药物,治疗呼吸道合胞病毒感染仍有巨大的未满足的医疗需求 --选定了ASC10以800毫克、每天两次的剂量在呼吸道合胞病毒感染患者中开展IIa期研...
歌礼宣布口服病毒聚合酶抑制剂ASC10猴痘适应症新药临床试验申请获得中国国家药监局批准
-- 临床前研究显示,双前药ASC10的活性代谢物ASC10-A对猴痘病毒和新型冠状病毒均具有强效抗病毒活性 -- ASC10和衍生物用于治疗多种病毒感染的化合物专利及其用途专利申请已收到美国专利与...
歌礼宣布与先声签订利托那韦片供应协议
杭州和绍兴2023年1月17日 /美通社/ -- 歌礼制药有限公司(香港联交所代码:1672,“歌礼”)今日宣布其全资附属公司歌礼药业(浙江)有限公司与先声药业集团有限公司(香港联交所代码:2096...
歌礼宣布新冠口服3CLpro抑制剂ASC11多剂量递增I期临床试验完成首个队列4名健康受试者给药
--该多剂量递增I期临床试验计划入组72名健康受试者,入组预计将于2023年第一季度完成 --歌礼已在全球范围内递交多项ASC11和相关化合物及其治疗病毒性疾病用途的专利申请 中国杭州和绍兴202...
歌礼认为Viking制药的控告没有根据,并将有力地进行抗辩
中国杭州和绍兴2023年1月2日 /美通社/ -- 歌礼制药有限公司(香港联交所代码:1672,“歌礼”)近日获悉,Viking Therapeutics, Inc.(“Viking”,一家位于美国...
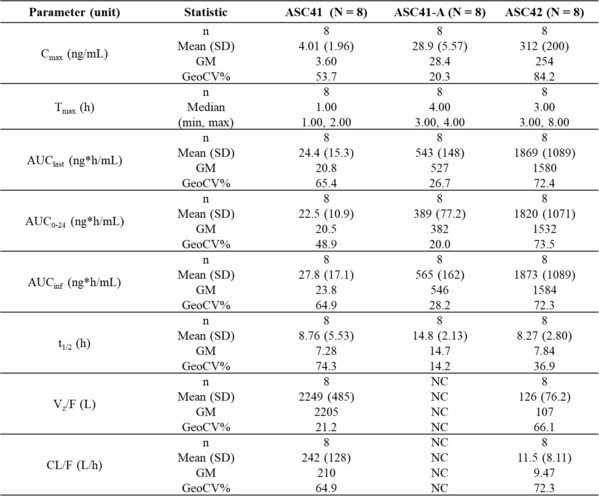
歌礼NASH研发管线创新药ASC41(THRβ) II期入组顺利推进
中国杭州和绍兴2022年12月21日 /美通社/ -- 歌礼制药有限公司(香港联交所代码:1672,"歌礼")的全资子公司甘莱制药有限公司自主研发的甲状腺激素受体β(THRβ)激动剂ASC41用于...
歌礼宣布口服病毒聚合酶抑制剂ASC10和衍生物收到美国专利授权公告通知书
--美国专利与商标局(USPTO)专利授权公告日期为2023年1月3日。专利公告号为11,541,071 --授权专利为ASC10和衍生物用于治疗病毒性感染的化合物专利及其用途专利,包括治疗新冠病毒...
歌礼宣布新冠口服RdRp抑制剂ASC10取得积极I期临床结果
--双前药ASC10在中国受试者中每次800毫克、每天两次给药后,活性药物ASC10-A的暴露量为单前药莫诺拉韦在日本受试者中每次800毫克、每天两次给药后 ASC10-A的暴露量的94% --基于...
歌礼宣布新冠口服3CLpro抑制剂ASC11新药临床试验申请获得中国国家药监局批准
--I期临床试验目标是为在新冠患者中开展关键II/III期临床试验确定安全且有效的剂量,I期临床预计在2023年第一季度内完成 --I期临床试验也将确认ASC11是否需要利托那韦强化 --抗病毒细...
歌礼宣布脂肪酸合成酶抑制剂ASC40治疗痤疮II期临床试验完成180例患者入组
--截至目前,约50%已入组的患者已经完成了12周治疗,所有已入组患者预计将于2023年2月底完成12周治疗 --在已完成ASC40或安慰剂12周治疗的患者中观察到的临床疗效与美国FDA批准的两...
歌礼宣布新冠口服3CLpro抑制剂ASC11新药临床试验申请获得中国国家药监局受理
中国杭州和绍兴2022年11月29日 /美通社/ -- 歌礼制药有限公司(香港联交所代码:1672,"歌礼")今日宣布其COVID-19("新冠")口服候选药物蛋白酶(3CLpro)抑制剂ASC11...
歌礼宣布新冠口服药物3CLpro抑制剂ASC11新药临床试验申请获美国FDA批准
--该项I期临床试验将在健康受试者中开展,分为3个队列,包括单剂量和多剂量递增研究以及食物影响研究。该试验的目标是为在新冠病人中开展关键II/III 期临床试验确定合适剂量 --在新冠病毒感染的抗病...
歌礼宣布口服PD-L1小分子抑制剂ASC61用于治疗晚期实体瘤新药临床试验申请获得中国国家药监局批准
--ASC61美国I期试验正有序进行,中国新药临床试验(IND)获批将加速ASC61全球开发,ASC61是一款由歌礼自主研发的口服PD-L1小分子抑制剂 中国杭州和绍兴2022年11月17日 /美...
歌礼宣布病毒聚合酶抑制剂ASC10猴痘适应症新药临床试验申请获得美国FDA批准
--基于已有数据,美国食品药品监督管理局(FDA)已批准ASC10以800毫克、每天两次的剂量在猴痘病毒患者中开展Ib期研究 --临床前研究显示,双前药ASC10的活性代谢物ASC10-A对猴痘病...
歌礼宣布在2022年美国肝病研究协会年会以壁报形式报告ASC43F治疗NASH的I期单剂量研究
中国杭州和绍兴2022年11月7日 /美通社/ -- 歌礼制药有限公司(香港联交所代码:1672,"歌礼")今日宣布ASC43F治疗非酒精性脂肪性肝炎(NASH)的I期单剂量研究摘要已在2022年美...
歌礼宣布新冠口服药物3CLpro抑制剂ASC11递交美国新药临床试验申请
-- ASC11是自主研发的靶点为蛋白酶(3CLpro)的口服小分子候选药物 -- 在新冠病毒感染的抗病毒细胞实验中,与奈玛特韦、S-217622、PBI-0451 和 EDP-235等其它3CLp...